リサーチハイライト
Vol.7, July 2016
相互作用で難治がんに効果を発揮
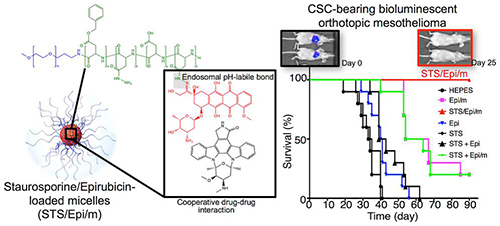
日本の研究者によって、ミセルに封入した2剤の相互作用を利用した、難治がんに対する新たなナノテク抗がん剤が開発された。マウスモデルを使ったin vitroおよびin vivo試験において、スタウロスポリンとエピルビシンを搭載したpH応答性のミセル(ナノ粒子)を投与したところ、薬剤耐性がん細胞が有意に減少し、生存期間が延びた。
ナノ医療イノベーションセンターの片岡一則ら、ならびに東京大学、九州大学および東京工業大学の研究者らは、ミセルに2剤を封入したナノ治療薬の悪性中皮腫に対する効果を検討した。悪性中皮腫は、治療抵抗性のがん幹細胞を多く含む侵襲性の強いがんである。治療しても、がん幹細胞が残存すると、再発、転移を引き起こす。
スタウロスポリンは強力なプロテインキナーゼ阻害作用を有することから、がん幹細胞に不可欠な多数の経路を阻害する。一方、細胞傷害作用を有するエピルビシンについては、ピンポイントで腫瘍に薬剤を送達するミセル化ナノ粒子に封入された、エピルビシンミセルがすでに開発されている。しかし、一部のがん細胞はエピルビシンに抵抗性を示す。エピルビシンミセルにスタウロスポリンを封入することで、腫瘍のさまざまな薬剤耐性機序を抑制し、がん細胞のみならずがん幹細胞を殺傷できる。
さらに、薬剤をミセルに封入することで、健常細胞の薬剤への曝露を防いだ。エンドソーム内の低pH環境に応答してミセルが崩壊し、薬剤が放出された。エンドソームとは、細胞内へと取り込まれた物質が分解前に貯蔵される、細胞膜が陥没した小胞である。
蛍光試験により、エピルビシンの存在下ではスタウロスポリンの蛍光発光が低下することが示され、両剤の相互作用が確認された。
研究者らは、「今回の研究により、腫瘍内のがん細胞および治療抵抗性を持つがん幹細胞の殺傷が可能な薬剤を発見し、効果の高い2剤をナノ粒子内に封入することによって再発、転移を起こさないナノテク抗癌剤の開発に成功した」と結論している。
Publication and Affiliation
Hiroaki Kinoh,1 Yutaka Miura,2 Tsukasa Chida,2 Xueying Liu,2 Kazue Mizuno,2 Shigeto Fukushima,3 Yosuke Morodomi,4 Nobuhiro Nishiyama,5 Horacio Cabral,* 6 and Kazunori Kataoka*1,2,3,6 Nanomedicines eradicating cancer stem-like cells in vivo by pH-triggered intracellular cooperative action of loaded drugs ACS Nano, doi: 10.1021/acsnano.6b0090053 (2016).
†Innovation Center of NanoMedicine, 3-25-14 Tonomachi, Kawasaki-ku, Kawasaki 210-0821, Japan
- Center for Disease Biology and Integrative Medicine, Graduate School of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan
- Department of Materials Engineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan
- Department of Innovative Applied Oncology, Graduate School of Medical Sciences, Kyushu University, 3-1-1 Maidashi, Higashi-ku, Fukuoka, 812-8582, Japan
- Polymer Chemistry Division, Chemical Resources Laboratory, Tokyo Institute of Technology, R1-11, 4259 Nagatsuta, Midori-ku, Yokohama 226-8503, Japan
- Department of Bioengineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan
*corresponding author, e-mail address: horacio@bmw.t.u-tokyo.ac.jp;
kataoka@bmw.t.u-tokyo.ac.jp
Figure: