リサーチハイライト
Vol.3, March 2015
三層構造ナノマシンで治療遺伝子をピンポイント導入
難治性疾患治療に向けたドラッグデリバリーの開発では、限られた血管透過性、低い組織透過性、あるいは薬剤耐性といったさまざまな生物学的課題を克服しなければならない。有望な手段として、標的部位に生物活性物質を直接送達するナノマシンがある。時空間的に制御可能な「スイッチ」を使って治療薬の放出を標的部位に限定することで、副作用を最小限に抑えることができる。
これまでin vitro(生体外)試験で良好な結果が得られている。今回、東京大学の片岡一則教授が率いる研究チームは、光応答性ナノマシンを使ったin vivo(生体内)試験で、固形腫瘍に対する遺伝子導入に成功した。
ピンポイントで薬剤を放出させるべく、同チームは光化学的内在化を用いた。これは、レーザー光をスイッチとして使用する、制御されたプロセスである。レーザー光を照射すると、感光性のナノマシンがエンドソーム・リソソーム膜を壊し、遺伝子を放出する。研究者らが直面した最大の課題はコンポーネントのコンパートメント化であった。遺伝子を運ぶプラスミドDNAを内包した内核は、感光性化合物と直接接触すると、ダメージを受けてしまうのだ。
このような課題に対応すべく、段階的な自己組織化技術を使うことで、空間的に隔てられた三層のコンパートメントから成る三層構造高分子ミセルが構築された。同ミセルは遺伝子を内包した内核、光増感剤を搭載した中間層、および内核を保護する外殻層で構成される。
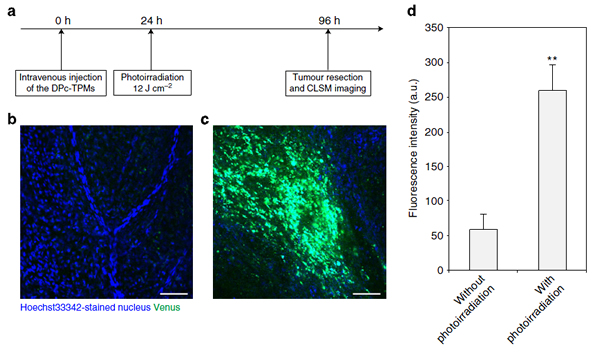
マウスの皮下腫瘍への送達状況を検証するため、治療用DNAには蛍光レポーター遺伝子がつながれた。ナノマシンの静脈注射後、腫瘍に光を照射すると、非照射の腫瘍と比較して蛍光発光が4.4倍となり、全身投与後の遺伝子導入の成功が確認された。野本貴大らにより構築された三層構造高分子ミセルのコンセプトは、高分子化合物を介したドラッグデリバリーの開発に向けた大きな可能性を秘めている。
Publication: Nat. Commun. 5, 3545 (2014)
Takahiro Nomoto1, Shigeto Fukushima2, Michiaki Kumagai2, Kaori Machitani2, Arnida2, Yu Matsumoto3, Makoto Oba4, Kanjiro Miyata3, Kensuke Osada1,5, Nobuhiro Nishiyama6 & Kazunori Kataoka1,2,3
Affiliations:
- Department of Bioengineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan.
- Department of Materials Engineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan.
- Center for Disease Biology and Integrative Medicine, Graduate School of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan.
- Graduate School of Biomedical Sciences, Nagasaki University, 1-14 Bunkyo-machi, Nagasaki 852-8521, Japan.
- Precursory Research for Embryonic Science and Technology (PRESTO), Japan Science and Technology Agency (JST), 4-1-8 Honcho, Kawaguchi, Saitama 332-0012, Japan.
- Polymer Chemistry Division, Chemical Resources Laboratory, Tokyo Institute of Technology, R1-11, 4259 Nagatsuta, Midori-ku, Yokohama 226-8503, Japan
Figure: