リサーチハイライト
Vol.16, September 2019
がんへ核酸医薬を安定に届けるナノマシンを開発
核酸医薬は、がんの新たな治療薬候補である。核酸医薬とは、DNAやRNAを構成するオリゴヌクレオチドを薬効成分とし、がんを始めとして様々な難病の治療薬になりうる次世代の医薬品である。核酸医薬は生体内では不安定であるため、多くの場合、ナノ粒子に内包した形で体内に注入される。しかし、ナノ粒子には、その大きさゆえに膵臓がんや脳腫瘍などのいわゆる難治がんには効率良く到達できないという欠点がある。今回、東京大学の宮田完二郎准教授と川崎市産業振興財団ナノ医療イノベーションセンターの片岡一則センター長が率いるチームにより、ナノ粒子を用いずに核酸医薬を安定に保護し、難治がんに送達するナノマシンが開発された。
研究チームは、負に帯電している核酸医薬と生体内でドッキング(結合)する、正の電荷を有するY字型ポリマーを開発した。核酸医薬の一種であるsiRNAとY字型ポリマーの生体内ドッキングを検証すべく、それぞれを別々にマウスの血液中に投与した。その結果、これらはマウスの血流中でしっかりとドッキングし、「核酸医薬搭載ナノマシン」となることで長く安定に血中を循環した。さらに、腫瘍組織への到達能を検証するため、研究チームは核酸医薬搭載ナノマシンをヒト膵臓がん移植マウスに投与した。結果として、siRNAは肝臓などの正常な組織にはほとんど集積しない一方で、膵臓がん組織には極めて効率良く集積することが明らかになった。
siRNAは、細胞の中で特定の病因遺伝子の発現を抑制することで薬効を示す。そのため、核酸医薬搭載ナノマシンの薬効評価にあたり、がんの増殖に関与する遺伝子であるPLK1に特異的なsiRNAが使われた。実際に、膵臓がん細胞中でPLK1が抑制され、腫瘍の増殖が抑制された。脳腫瘍については、さらに強力な治療効果が認められた。もう一種の核酸医薬であるアンチセンス核酸もY字型ポリマーとドッキングし、脳腫瘍組織に到達した。また、アンチセンス核酸は、脳腫瘍の増殖を促す遺伝子であるTUG1を抑制し、ヒト脳腫瘍同所移植マウスの生存率を劇的に改善した。
本ナノマシンのがん治療薬としての実用化に向けては、さらに多くの種類のがんで検証する必要があるものの、今回の結果により新たな核酸医薬デリバリーシステムの可能性が示された、と研究チームは確信を持っている。「生体バリアによって到達が阻まれる難治がんに対して、核酸医薬によるがん治療の大きな可能性が示された」と研究チームは結論づけている。
Reference and Affiliations:
Sumiyo Watanabe1,2,3,13, Kotaro Hayashi4,13, Kazuko Toh4,13, Hyun Jin Kim 1,13, Xueying Liu4, Hiroyuki Chaya1,5, Shigeto Fukushima4, Keisuke Katsushima6, Yutaka Kondo6, Satoshi Uchida7, Satomi Ogura4,5, Takahiro Nomoto8, Hiroyasu Takemoto8, Horacio Cabral7, Hiroaki Kinoh4, Hiroyoshi Y. Tanaka9, Mitsunobu R. Kano9,10, Yu Matsumoto1, Hiroshi Fukuhara11, Shunya Uchida2, Masaomi Nangaku3, Kensuke Osada7, Nobuhiro Nishiyama8, Kanjiro Miyata1,5,14 & Kazunori Kataoka4,12,14. In vivo rendezvous of small nucleic acid drugs with charge-matched block catiomers to target cancers. Nature Communications 10 (2019)
- Center for Disease Biology and Integrative Medicine, Graduate School of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan.
- Division of Nephrology, Department of Internal Medicine, Teikyo University School of Medicine, 2-11-1 Kaga, Itabashi-ku, Tokyo 173-8605, Japan.
- Division of Nephrology and Endocrinology, Graduate School of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8544, Japan.
- Innovation Center of NanoMedicine, Kawasaki Institute of Industrial Promotion, 3-25-14 Tonomachi, Kawasaki-ku, Kawasaki 210-0821, Japan.
- Department of Materials Engineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan.
- Division of Cancer Biology, Nagoya University Graduate School of Medicine, 65 Tsurumai-cho, Showa-ku, Nagoya 466-8550, Japan.
- Department of Bioengineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan.
- Laboratory for Chemistry and Life Science, Institute of Innovative Research, Tokyo Institute of Technology, R1-11, 4259 Nagatsuta, Midori-ku, Yokohama 226-8503, Japan.
- Department of Pharmaceutical Biomedicine, Okayama University Graduate School of Medicine, Dentistry, and Pharmaceutical Sciences, 1-1-1 Tsushima-naka, Kita-ku, Okayama-shi, Okayama Prefecture 700-8530, Japan.
- Department of Pharmaceutical Biomedicine, Okayama University Graduate School of Interdisciplinary Science and Engineering in Health Systems, 1-1-1 Tsushima-naka, Kita-ku, Okayama-shi, Okayama Prefecture 700-8530, Japan.
- Department of Urology, Kyorin University Faculty of Medicine, 6-20-2 Shinkawa, Mitaka, Tokyo 181-8611, Japan.
- Institute for Future Initiatives, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan.
- These authors contributed equally: Sumiyo Watanabe, Kotaro Hayashi, Kazuko Toh, Hyun Jin Kim.
- These authors jointly supervised this work; Kanjiro Miyata, Kazunori Kataoka. Correspondence and requests for materials should be addressed to K.M. (email: miyata@bmw.t.u-tokyo.ac.jp) or to K.K. (email: kataoka@ifi.u-tokyo.ac.jp)
Figure:
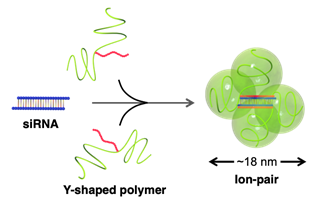
Y字型ポリマーとsiRNAがドッキングし、核酸医薬搭載ナノマシンを形成






