リサーチハイライト
Vol.11 January 2018
グルコースで表面を機能化ナノマシンが血液脳関門を通過して薬剤を正確に送達
がんなど疾患部位選択的に医薬品を送達する方法は、副作用の軽減といった恩恵を患者にもたらす。近年、特に透過性の高い血管のある部位を標的として薬剤を送達する画期的な方法として、いわゆる「ナノマシン」が開発され、がん治療を対象とした臨床試験が開始している。
しかし、血液脳関門(Blood-brain barrier:BBB)などの透過性の低い血管のある標的部位は、ナノマシンとその薬剤の行く手を阻む障害である。BBBを通過する薬剤の設計や技術開発が進められているものの、送達率は非常に低い。今回、日本の研究者らは、高い効率でBBBを通過し、脳内に到達できるナノマシンの開発に成功した。
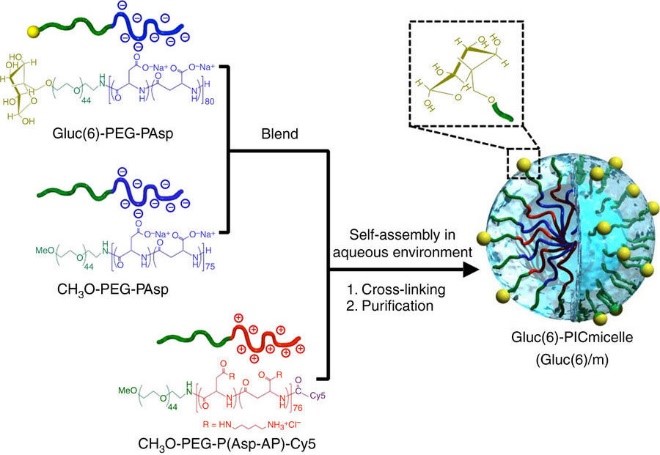
ナノ医療イノベーションセンターの片岡一則センター長、東京医科歯科大学の横田隆徳教授と、川﨑市産業振興財団、東京医科歯科大学、東京大学および東京工業大学の研究者らは、BBBの主要構成要素である脳血管内皮細胞の表面に多く存在するグルコーストランスポーター1(GLUT1)を標的とするナノマシンを開発した。研究者らは、空腹状態での食事による血糖値の変化(上昇)を利用してナノマシンの取り込みを高めた。高分子ミセル型ナノマシンの表層には、GLUT1に結合しやすい配置と密度でグルコースが導入された。GLUT1過剰発現細胞を使って、in vitroで結合と取り込みが確認された。
一方、in vivo取り込みは、マウスを対象に、グルコース結合ナノマシンを注射することで検討された。24時間絶食させたマウスにナノマシンを注射し、続いてグルコース溶液を投与したところ、脳によるナノマシン取り込みが56倍上昇し、最大で投与量の約6%が集積した。このような効果は脳内でのみ確認されており、本戦略の高い選択性を支持している。またグルコース溶液の投与後30分以内に脳実質でナノマシンが確認された。これはナノマシンがBBBを通過したことを示している。さらに、ナノマシン上のグルコース密度を調整することで脳内での分布に差が生じたことから、脳内における特異的な標的設定の可能性が示唆された。
「各疾患でのBBB構造を適切に反映した動物モデルを使用し、グルコース結合ナノマシンの構造とグルコース調整条件を最適化することで、今回の研究結果の臨床的意義をさらに検討する必要がある」と、著者らは結論している。
Publication and Affiliations
Y. Anraku1, H. Kuwahara2,3, Y. Fukusato1, A. Mizoguchi4, T. Ishii1, K. Nitta2,3, Y. Matsumoto 4,5, K. Toh6, K. Miyata4,7, S. Uchida1,4, K. Nishina2,3, K. Osada1, K. Itaka4, N. Nishiyama8, H. Mizusawa2,3, T. Yamasoba5, T. Yokota*2,3, K. Kataoka*6,9 . Glycaemic control boosts glucosylated nanocarrier crossing the BBB into the brain. Nature Communications 8 (2017) DOI: 10.1038/s41467-017-00952-3
- Department of Bioengineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan.
- Department of Neurology and Neurological Science, Graduate School of Medical and Dental Sciences, Tokyo Medical and Dental University (TMDU), 1-5-45 Yushima, Bunkyo-ku, Tokyo 113-8519, Japan.
- Center for Brain Integration Research, Tokyo Medical and Dental University (TMDU), 1-5-45 Yushima, Bunkyo-ku, Tokyo 113-8519, Japan.
- Center for Disease Biology and Integrative Medicine, Graduate School of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan.
- Department of Otorhinolaryngology and Head and Neck Surgery, Graduate School of Medicine and Faculty of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan.
- Innovation Center of NanoMedicine, Kawasaki Institute of Industrial Promotion, 3-25-14 Tonomachi, Kawasaki-ku, Kawasaki 210-0821, Japan.
- 7 Department of Materials Engineering, Graduate School of Engineering, The University of Tokyo, 7- 3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan.
- Laboratory for Chemistry and Life Science, Institute of Innovative Research, Tokyo Institute of Technology, R1-11, 4259 Nagatsuta, Midori-ku, Yokohama 226-8503, Japan.
- Policy Alternatives Research Institute, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan. Y. Anraku, H. Kuwahara and Y. Fukusato contributed equally to this work.
Corresponding authors, T.Y. (email: tak-yokota.nuro@tmd.ac.jp) or K.K. (email: kataoka@bmw.t.u-tokyo.ac.jp)
Figure: