抗がん剤が効果を発揮するためには、抗がん剤ががん細胞へ到達する必要がある。今回、日本の研究者によって、特定の種類の脳腫瘍に対して薬剤を効果的に送達する方法が見出された。特別に設計された高分子ミセルに抗がん剤のエピルビシンを内包するという方法である。マウスモデルを用いた試験では、同ミセルを使うことで抗腫瘍効果が12倍高まった。これは、脳腫瘍の持つ薬剤抵抗性の克服に向けた非常に有望かつ医療にトランスレーション可能なアプローチである。
片岡一則と川崎市産業振興財団、東京大学および東京工業大学の研究者らは、多形性膠芽腫に対してこの方法を適用した。多形性膠芽腫は悪性度の高い脳腫瘍であり、3年を超えて生存する患者は5%にも満たない。脳血管に存在する血液脳関門は、血液から脳への薬物移行を厳しく制御しており、これが多形成膠芽腫の薬剤抵抗性の主な原因と考えられる。従って、薬剤が標的である脳腫瘍に到達し、治療濃度に達するためには、血液脳関門を通過しなければならない。
エピルビシンは膠芽腫に対して強い効果を示す抗がん剤であり、その効果は現在医療現場で一般的に使用されているテモゾロミドよりも高いが、血液脳関門の通過率が低い。エピルビシンの送達効率を高めるべく、研究者らは、エピルビシン内包ミセルの表面を環状アルギニン-グリシン-アスパラギン酸(cRGD)ペプチドで修飾した。cRGDペプチドは、インテグリン(細胞膜に存在するレセプター)がかかわる細胞接着機構に関与する生体分子である。cRGDペプチドは、多形性膠芽腫の細胞および血管系で過剰発現するανβ3およびανβ5インテグリンを標的とし、特異的に結合する。そのため、cRGDペプチドで修飾したエピルビシン内包ミセルは血液脳関門を通過しやすくなると考えられる。
膠芽腫の多細胞スフェロイドモデルに対するミセルの浸透性を評価するin vitro試験では、cRGD修飾エピルビシン内包ミセルは、cRGD未修飾の同ミセルに比してスフェロイドの深部まで浸透することが示された。一方、腫瘍の生体発光イメージングを利用したin vivo試験では、cRGD修飾ミセルは、多形性膠芽腫の同所移植モデルにおいて腫瘍の成長を効果的に抑制することが示された。cRGD未修飾のエピルビシン内包ミセルについては既に臨床試験が進められていることから、研究者らは、「エピルビシン内包ミセルの表面をcRGDペプチドで修飾することで、効果的な脳腫瘍治療薬としての臨床応用が広がる可能性がある」と期待している。
Publication and Affiliation
S. Quader,1 X. Liu,1 Y. Chen,2 P. Mi,1 T. Chida,2 T. Ishii,2 Y. Miura,3 N. Nishiyama,4 H. Cabral,2 K. Kataoka*1,5 cRGD peptide-installed epirubicin-loaded polymeric micelles for effective targeted therapy against brain tumors Journal of Controlled Release, doi: 10.1016/j.jconrel.2017.04.033 (2017)
- Innovation Center of Nanomedicine, Kawasaki Institute of Industrial Promotion, 3-25-14 Tonomachi, Kawasaki-ku, Kawasaki 212-0821, Japan
- Department of Bioengineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan
- Center for Disease Biology and Integrative Medicine, Graduate School of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan
- Laboratory for Chemistry and Life Science, Institute of Innovative Research, Tokyo Institute of Technology, R1-11, 4259 Nagatsuta, Midori-ku, Yokohama 226-8503, Japan
- Policy Alternatives Research Institute, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-1709, Japan
*corresponding author, e-mail address: k-kataoka@kawasaki-net.ne.jp
Figure:
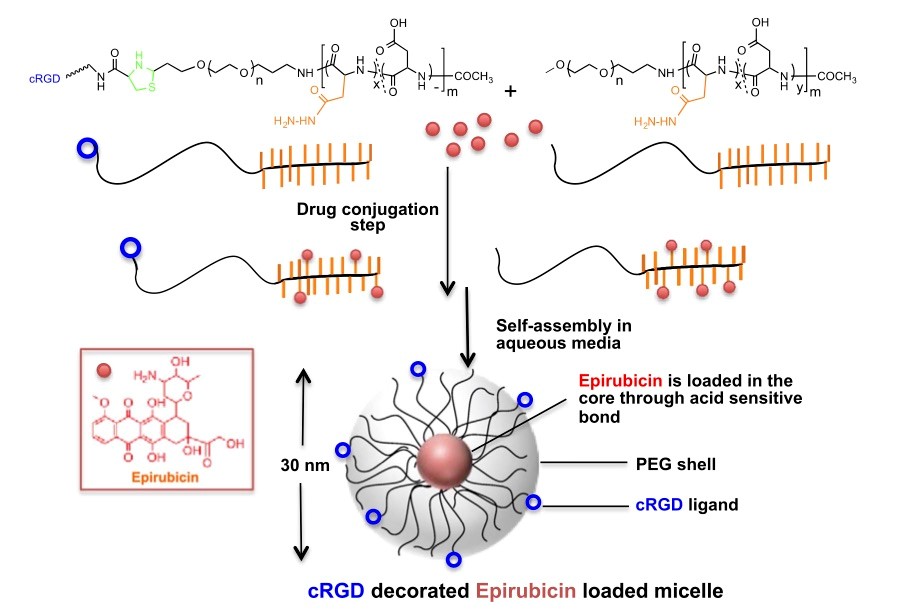
(図中項目:上から下、左から右へ)
薬物結合
水中で自己組織化
酸開裂性結合を通じて内核にエピルビシンを内包
エピルビシン
PEG外殻
cRGDリガンド
cRGD修飾エピルビシン内包ミセル
cRGD修飾エピルビシン内包ミセルの合成と構造。マウスモデルで多形性膠芽腫の成長を抑制することが示された。

