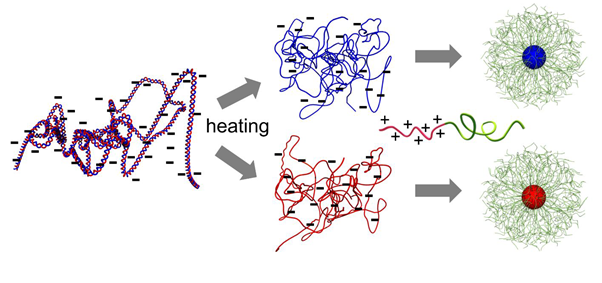
遺伝子治療の中には、標的となる細胞の核に特殊任務を請け負った遺伝子(タンパク質の設計図)を導入するものがある。導入された遺伝子が機能発現し、その遺伝情報に則したタンパク質を産生し、最終的にアポトーシス(細胞が自らを死に追いやるプロセス)を誘発する。このような遺伝子を標的細胞核内に到達させることは容易ではない。従来の方法では、遺伝子を搭載した「パッケージ」が一定のサイズを超えると、標的のがん細胞に到達できない。今回、川崎市産業振興財団ナノ医療イノベーションセンター(iCONM)の片岡一則らは、遺伝子をコンパクトに丸めてナノマシンに封入する技術を確立した。これにより、サイズが大きすぎて標的細胞核に目的の遺伝子を送達できないという課題を克服できる。
研究者らは、小型の一本鎖DNA(ssDNA)を持つアデノ随伴ウイルス(AAV)から着想を得た(DNAは二本鎖で二重らせん構造を有することが一般的)。重要なことに、AAV中の一本鎖DNAは機能を有しており、RNAにその遺伝情報を写して、タンパク質を産生することができる。
片岡らは、二重らせん構造のDNAを熱して二本鎖を一本鎖にすると同時に、高分子ミセル構造を有する球状のナノマシンに封入した。一本鎖DNAを搭載した球状のナノマシンを、研究者らは「MARU」(micellar assembly retaining unpaired ssDNA)と称する。電子顕微鏡を用いて測定したMARUの核のサイズはおよそ29nm(ナノメートル)と、二本鎖DNAを搭載した棒状ミセルよりもコンパクトである。MARUにはAAVに比してより大きなサイズのDNAを封入できることから、タンパク質の配列を決める、より多様なDNA物質を送達できる可能性が示唆される。
研究者らは、MARUが実際に遺伝子発現を活性化できることを確認した後、すい臓がん細胞核内に遺伝子を送達する「運び屋」としてMARUの評価を行った(サイズリミットはおよそ100nm)。すい臓がんを移植したマウス担がんモデルにMARUが静脈注射された。6時間後に腫瘍を切り取り、詳細に調べたところ、腫瘍内部にMARUが確認され、MARUの遺伝子送達能が示された。そして片岡らは、腫瘍を有するマウスでMARUを用いた遺伝子治療を行った。MARUには、5-フルオロシチジン(5-FC)を5-フルオロウラシル(5-FU)に変換する酵素タンパク質「シトシンデアミナーゼ」を産生するDNAが一重鎖として搭載された。アポトーシスを誘導する5-FUは抗がん剤として知られている。マウスには5-FCも注射された。MARUにより、がん細胞核内へ選択的に運ばれた遺伝子が発現してシトシンデアミナーゼが産生され、5-FCが5-FUに変換された結果、がん組織の成長が著しく抑制された。
片岡らの研究は、大きなサイズの一本鎖DNAを搭載したナノマシンによる遺伝子治療の将来性を示すだけでなく、一本鎖DNAの遺伝子発現力のさらなる理解という点で興味深い。研究者らは、「(MARUは)今後解明すべき一本鎖DNAの基本機能に関与する根本的メカニズムの研究に役立つ可能性がある」としている。
Reference:
Tockary, Theofilus A. et al. Single-Stranded DNA-Packaged Polyplex Micelle as Adeno-Associated-Virus-Inspired Compact Vector to Systemically Target Stroma-Rich Pancreatic Cancer.
ACS Nano 13,12732-12742 (2019)
https://doi.org/10.1021/acsnano.9b04676
Figure: [Scheme 1 from the paper]